Isotiocianato de fluoresceína
| Isotiocianato de fluoresceína | ||
|---|---|---|
 | ||
| General | ||
| Otros nombres | FITC | |
| Fórmula semidesarrollada | C21H11NO5S | |
| Fórmula estructural |
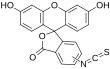 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| PubChem | 18730 | |
Isotiocianato de fluoresceína o fluoresceína-5-isotiocianato, también llamado FITC por sus siglas en inglés (Fluorescein IsoTioCyanate) es una molécula que pertenece al grupo de los colorantes de xanteno. Es un fluorocromo derivado de la fluoresceína. Los fluorocromos son moléculas capaces de emitir fluorescencia al ser excitadas a ciertas longitudes de onda. Cada fluorocromo presenta un espectro de absorción y de emisión característico. Entre los fluorocromos más usados en inmunohistoquímica figuran la fluoresceína, el isoticianato de fluoresceína, la rodamina B, el isotiocianato de rodamina B, el DANS y cloruro de dansilo. A pesar de que el isoticianato de fluoresceína se altera cuando se almacena durante periodos largos de tiempo, es más estable que la fluoresceína.
Características
[editar]Isotiocianato de fluoresceína es la molécula de fluoresceína original funcionalizada con un isotiocianato de grupo reactivo ( -N = C = S ), en sustitución de un hidrógeno en el átomo de anillo de la parte inferior de la estructura. Este derivado es reactivo frente a nucleófilos, incluyendo grupos amina y sulfhidrilo de proteínas. Un succinimidil-éster es un grupo funcional unido al núcleo de fluoresceína, la creación de NHS-fluoresceína , forma otro derivado reactivo amina común que tiene mucho mayor especificidad hacia las aminas primarias en la presencia de otros nucleófilos. Las moléculas orgánicas pequeñas como FITC forman una unión covalente con grupos amino libres en anticuerpos. Hay varios de este tipo, como isoticianato de fluoresceina, phicoeritrina, rodamina, rojo texas, cianinas. El más utilizado para marcar proteínas es isotiocianato de fluoresceína, el grupo isotiocianato reacciona con los grupos amino de los residuos de lisina.
Antecedentes Históricos
[editar]El desarrollo de la metodología de anticuerpos marcados con isotiocianato de fluoresceína, la inmunofluorescencia indirecta, realizado por Albert H Coons, Hugh Creech, Norman Jones y Ernst Berlinier, en la Universidad de Harvard en 1941, fue el antecedente del florecimiento de la inmunopatología[1] que le permitió a Coons el estudio detallado de diversos antígenos, la identificación de proteínas tisulares, la detección de complejos inmunitarios, la localización de antígenos virales en células infectadas y de antígenos tumorales en diversas neoplasias. Este método creado por Coons y colaboradores sentó las bases de la inmunohistoquímica actual.
En 1977 Michael R. Loken midió simultáneamente dos antígenos celulares con un solo láser, empleó la compensación electrónica de la señal entre isiotiocianato de fluoresceína y tetralmetilrodamina.
Usos y aplicaciones
[editar]El isotiocianato de fluoresceína se usa para el marcado de diversas biomoléculas como inmunoglobulinas, lectinas, diversas proteínas, péptidos, ácidos nucleicos, polinucleótidos, oligo y polisacáridos.El anticuerpo marcado con un fluorocromo reacciona con el antígeno específico cuya presencia se quiere determinar y se observa el resultado de la reacción con un microscopio de fluorescencia. El fluorocromo usado para marcar los anticuerpos es el isotiocianato de fluoresceína y el anticuerpo marcado se denomina conjugado. Los productos así marcados se usan como reactivos para tinciones de hibridación de afinidad, inmunológica e in situ en cortes, pero también para la tinción de células vivas y para la tinción en métodos de citometría de flujo. Los cortes de tejidos y monolayers celulares pueden teñirse con FITC según diversos métodos.
Se utiliza en una gran cantidad de aplicaciones, como la citometría de flujo, tasa de filtración glomerular, marcando la combinación de anticuerpos,[2] que es la tinción más utilizada,[3] técnicas de inmunofluorescencia en donde se utilizan como marcadores compuestos de fluoresceína.
La microscopia de inmunofluorescencia es una técnica inmunohistoquímica que consiste en conjugar colorantes fluorescentes (isotiocianato de fluoresceína, rodamina B de lisamina o ácido 1-dimetilaminonaftalen-5-sulfónico) con anticuerpos o antígenos, exponiendo después este conjugado a los anticuerpos o antígenos correspondientes en cortes de tejidos, frotis de microorganismos o de células, o cultivo de tejidos en capa única. Cuando la reacción es positiva y se expone a la luz ultravioleta se producirá fluorescencia observable bajo el microscopio de inmunofluorescencia.
Espectroscopía
[editar]
Los espectros de excitación y de emisión suelen presentar gran simetría en longitud de onda larga. Esta regla es aplicable a cualquier fluorocromo y fue descubierta por Lewshin.[4]
El estudio de estas curvas espectrales ponen de manifiesto que la intensidad de la fluorescencia guarda relación tanto con la intensidad de la radiación excitante como con la producción de cuantos. Toda radiación que parte de un manantial luminoso se cede en forma de pequeños paquetes de energía llamados cuantos.
En su espectro de excitación tiene un pico máximo de 492 nm y un pico mínimo de 320 nm. La emisión máxima se realiza a los 518 nm, en la región verde-azulada del espectro, color que puede modificarse al introducir filtros amarillos. El isotiocianato de fluoresceína emite luz verde amarillenta intensa.
Referencias
[editar]- ↑ Taylor CR. Principles of immunomicroscopy. In: Immunomicroscopy. A diagnostic Tool for surgical phatologists. Mayor problems in Phatology. Third edition. New York: Saunders, 2006;pp: 1-46
- ↑ FITC conjugation of Antibodies - www.drmr.com (em inglês)
- ↑ Márjorie A. Golim et al; Conjugação e validação de controle isotípico IgG1-FITC para uso em citometria de fluxo; Rev. Bras. Hematol. Hemoter. vol.29 no.4 São José do Rio Preto Oct./Dec. 2007; doi: 10.1590/S1516-84842007000400008
- ↑ Martínez Ricardo, Gragera Raquel: Fundamentos teóricos y prácticos de la histoquímica, Edición CSIC, pags 196-197
